Dans le cadre d’un article précédent détaillant le fonctionnement d’un laser, j’ai présenté le phénomène d’émission spontanée : un atome dans un état excité, c’est-à-dire possédant un surplus d’énergie, ne reste pas dans cet état indéfiniment et restitue cette énergie en émettant de la lumière, un photon. Ce phénomène, que vous découvrez peut-être, vous est en fait familier. Il est responsable de ce qu’on appelle la fluorescence, et de la phosphorescence. Attention, les deux termes ne sont pas synonymes ! Alors quelle est la différence ?
Quand parle-t-on de fluorescence et de phosphorescence ?
Tout d’abord, on parle de fluorescence et de phosphorescence lorsque l’on a affaire à un cycle {absorption d’un photon + émission spontanée}. Le phénomène d’absorption est en quelque sorte le contraire de l’émission spontanée : l’atome prend l’énergie du photon, qui est alors détruit, et un électron transite d’une orbitale à une autre. Attention : comme celui émis, le photon reçu possède l’énergie adéquate (), sans quoi il ne peut pas être absorbé.
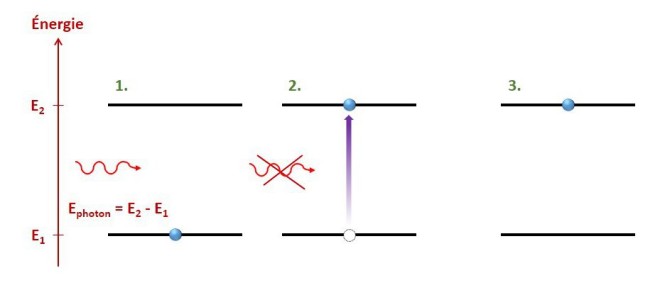
1. Arrivée d’un photon de la bonne énergie sur un atome dans l’état fondamental.
2. Transition de l’électron vers une orbitale de plus haute énergie et destruction du photon.
3. Atome dans l’état excité.
Il nous faut maintenant aller un peu plus loin en considérant deux choses : tout d’abord, le fait que le système (bien plus souvent une molécule qu’un seul atome) possède plusieurs électrons, et ensuite, le moment magnétique de spin de ces derniers.
« Le… quoi ? »
Le moment magnétique de spin. Je vais faire court et donc m’autoriser un certain nombre de raccourcis (vous voilà prévenus !). Vous connaissez la charge électrique ? C’est une propriété de la matière qui la rend sensible à la présence d’un champ électrique. Vous connaissez la masse ? Là encore une propriété de la matière, qui la rend sensible à la présence d’un champ gravitationnel. Hé bien le spin, c’est encore une autre de ces propriétés, et du spin découle le moment magnétique de spin, qui rend la matière sensible à un champ magnétique. Le moment magnétique de spin n’est pas l’équivalent d’une « charge magnétique » : il a une valeur et une orientation, là où la charge électrique et la masse se contentent d’une valeur. On le représentera donc par une flèche. Le moment magnétique de spin des électrons ne pourra prendre que deux orientations, vers le haut ou vers le bas. Quand plusieurs électrons se répartissent dans les diagrammes d’énergie que j’ai déjà montrés, ils n’ont le droit d’occuper la même orbitale qu’à une seule condition : leurs moments magnétiques doivent être d’orientations différentes. Dans le cas contraire, les états des électrons seraient rigoureusement identiques, et cela est interdit (c’est le principe de Pauli). Puisqu’ils ne peuvent être orientés que vers le haut ou le bas, il ne peut y avoir que deux électrons par orbitale.
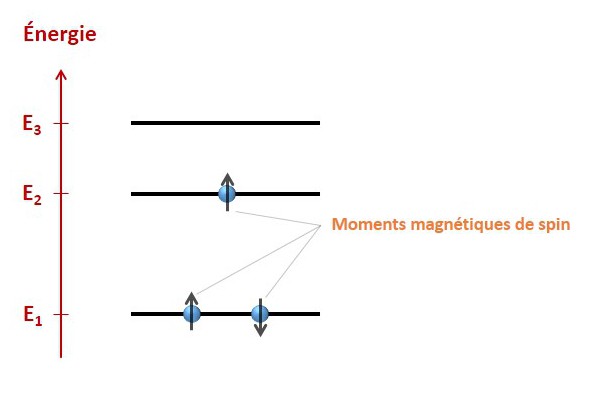
… pour 3 niveaux et 3 électrons. L’électron sur l’orbitale 2 ne peut pas occuper l’orbitale 1, puisqu’un électron avec le même moment magnétique l’occupe déjà. La configuration représentée est donc la configuration de plus basse énergie.
On peut maintenant faire la différence…
… entre fluorescence et phosphorescence.
Fluorescence : Après l’absorption d’un photon, l’électron excité retourne à l’état fondamental en en réémettant un. Rien de particulier ne se passe au niveau du spin. Le processus ne dure alors que quelques nanosecondes, autant dire qu’à notre échelle de perception, il est instantané. Ce qui veut dire aussi qu’un objet fluorescent ne peut pas être lumineux dans le noir !
Phosphorescence : Cette fois-ci, pour des raisons que je ne détaillerai pas, l’électron excité transite dans un autre niveau d’énergie particulier (un état dit triplet), où son spin s’est retourné. Il est donc bloqué dans cet état d’énergie ! En effet, le niveau d’énergie plus basse est déjà occupé par un électron de même spin, il lui est donc interdit d’y retourner. Il va quand même y parvenir, en se désexcitant et en retournant son spin simultanément. Ce processus aléatoire est cependant bien plus rare, et peut prendre des secondes, voire des heures ! Résultat, une fois qu’on a éclairé un matériau phosphorescent, celui-ci diffuse de la lumière au fur et à mesure que ses molécules parviennent à retourner à l’état fondamental. Plus on l’aura éclairé longtemps au préalable, plus il sera lumineux, puisqu’un nombre plus important de molécules se seront « coincées » dans l’état triplet. Les deux phénomènes sont résumés sur le schéma suivant :
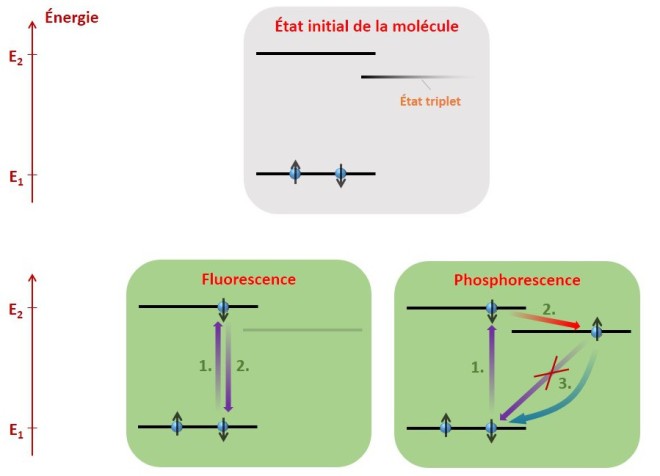
Fluorescence :
1. Absorption d’un photon.
2. Réémission du photon.
L’état triplet ne joue aucun rôle.
Phosphorescence :
1. Absorption du photon.
2. Retournement de spin (passage dans l’état triplet).
3. Un photon ne peut être réémis immédiatement (la transition classique est interdite).
L’électron doit effectuer la transition en retournant son spin, ce qui est beaucoup moins probable et peut arriver plusieurs heures après l’absorption. De ce fait, l’objet reste lumineux un certain temps dans le noir.
Un dernier point notable est qu’en réalité, la lumière absorbée et la lumière réémise ne sont pas forcément identiques. Cela vient du fait que la structure électronique des molécules est encore un peu plus riche que ce que j’ai précédemment présenté. Les molécules peuvent en effet vibrer, avec une certaine énergie. Ainsi, des sous-niveaux vibratoires existent, pour chaque niveau électronique, comme illustré ci-après.
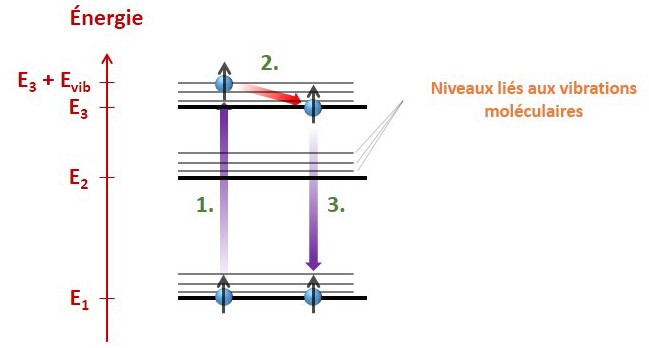
1. La molécule absorbe un photon d’énergie E3 + Evib – E1, ce qui porte l’électron dans l’état correspondant.
2. L’énergie Evib liée à la vibration est très rapidement perdue par la molécule, et cédée à son environnement en quelques picosecondes (millionième de millionième de seconde). Il n’y a pas d’émission de photon.
3. L’électron retombe dans l’état fondamental, et émet un photon d’énergie E3 – E1. Ce photon est d’énergie inférieure, donc de longueur d’onde supérieure (les deux quantités sont inversement proportionnelles).
Il est ainsi possible à une molécule d’absorber dans l’ultraviolet et de réémettre dans le spectre visible.
Les vibrations de la molécule s’atténuent rapidement en percutant les molécules voisines. De fait, l’énergie liée à ces vibrations est très rapidement perdue sans rayonner. Puis, une transition classique s’effectue en émettant un photon. Mais puisque les niveaux impliqués diffèrent entre l’absorption et l’émission, l’énergie du photon émis est inférieure à celle du photon absorbé. Et voilà comment vous devenez lumineux en boîte de nuit, si vous portez des vêtements blancs, lorsque l’on vous éclaire en « lumière noire » : les ultraviolets, qui ne sont pas perçus par l’œil humain, sont absorbés par les molécules fluorescentes et réémis dans le spectre visible, principalement le bleu. À noter d’ailleurs que les molécules fluorescentes en question ne constituent pas vos vêtements, elles proviennent des agents blanchissants contenus dans votre lessive, ou agents azurants.
 Enfin, fluorescence ne rime pas avec toxicité. La plupart des molécules fluorescentes sont dites aromatiques, elles ont une structure chimique spécifique. Mais, avec ce nom, vous vous doutez bien qu’une partie d’entre elles est responsable des arômes que nous percevons (j’ai bien dit cependant « une partie d’entre elles »). En outre, si l’on met une boisson tonique sous éclairage ultraviolet, ça donne le résultat ci-contre. Pourquoi ? Parce que la quinine qu’elle contient est fluorescente, et ça ne cause pas de problème de santé pour autant.
Enfin, fluorescence ne rime pas avec toxicité. La plupart des molécules fluorescentes sont dites aromatiques, elles ont une structure chimique spécifique. Mais, avec ce nom, vous vous doutez bien qu’une partie d’entre elles est responsable des arômes que nous percevons (j’ai bien dit cependant « une partie d’entre elles »). En outre, si l’on met une boisson tonique sous éclairage ultraviolet, ça donne le résultat ci-contre. Pourquoi ? Parce que la quinine qu’elle contient est fluorescente, et ça ne cause pas de problème de santé pour autant.
Quid des « fluctuations quantiques du vide » ? Elles viendront dans le prochain article !